医药云端工作室:挖掘趋势中的价值编辑:云中鹿
本周(10月13日-19日)
政策、市场、趋势、产品、公司
一 文 打 尽
点击每个段落的小标题,可进入原文详情
注射剂一致性评价技术文件出台!目前已有16品规过评
10月15日,国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》。至此,千呼万唤始出来的注射剂一致性评价技术文件终于出台。
米内网数据显示,2017年中国公立医疗机构终端注射剂市场接近6000亿元。公开数据显示,注射剂在我国样本医院占比超60%,单看西药领域,注射剂占比接近70%。可见,注射剂再评价是各企业必争的领域,从受理号来看,注射剂一致性评价在近两年也呈高速增长态势。
根据医药云端工作室统计,截至目前,注射剂过评药品有10个,涉及16个品规,其中按“通过质量和疗效一致性评价的药品”收录进上市药品目录集的只有普利制药的注射用阿奇霉素,其他均为视同过评。
2018年药品不良反应监测报告发布,基药情况与去年持平
10月15日,国家药品监督管理局药品评价中心发布《药品不良反应监测年度报告(2018年)》。报告显示,2018年全国药品不良反应监测网络累计收到不良反应报告表149.9万份,其中新的和严重不良反应报告49.5万份,分别较去年同期增长4.8%和14.3%。
2018年药品不良反应报告仍然以化学药品为主,占比超八成。中药不良反应报告比例较去年同期有所下降、生物制品略有上升。2018年国家基本药物监测总体情况基本保持平稳。
6类药品疫苗上市将获快速通道!药品注册、生产、经营3文件征意见
10月15日,国家市场监管总局发布通知,就《药品注册管理办法(征求意见稿)》《药品生产监督管理办法(征求意见稿)》《药品经营监督管理办法(征求意见稿)》社会公开征求意见。
在《药品注册管理办法(修订草案征求意见稿)》中,增设了药品加快上市注册一章,设立突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序四个加快通道,并明确每个通道的纳入范围、程序、支持政策、终止程序等要求。
意见稿明确,拟将包括临床急需的短缺药、儿童用药、罕见病用药、重大传染病用药、疾病防控急需疫苗和创新疫苗等6类药品纳入加快上市注册范围。申请人可以在提出药品上市注册申请的同时,向国家药品审评中心提出优先审评审批申请。
九大类64品种纳入第一批医械编码产品清单
10月14日,国家药监局印发了《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》,对第一批医疗器械唯一标识实施品种范围、进度安排、工作要求等进行了明确规定。自2020年10月1日起,生产列入首批实施目录的医疗器械,应当具有医疗器械唯一标识。
按照风险程度和监管需要,《通告》确定部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种。心脏起搏器、髋关节假体、整形用注射填充物等九大类64个品种被列入第一批实施医疗器械唯一标识的产品目录。
医用耗材采购管理编码即将统一,招采支付迎来洗牌
近日,国家卫健委统计信息中心组织起草了《WS/T医用耗材采购使用管理分类代码与标识码》,并向社会公开征求意见。这意味着,医保信息化统一工作进展又加快了一步,未来耗材招采和支付将迎来洗牌。
随着医保标准化工作的不断推进,再加上今年8月1日财政部对于医疗票据的统一,作为配合医保标准化工作的一项组合拳,使得各方面信息逐渐统一,这也说明,国家对医院终端的监管正不断加强,从药品到耗材,从采购到使用,这也将不断挑战药企原有的营销模式。
广东县域医共体将全省推开,牵头医院将“大权在握”,实现“6统一”
10月16日,广东省发布《加强紧密型县域医疗卫生共同体建设实施方案》,到2020年6月,实现全省所有县(市、区)县域医共体全覆盖。
到2020年底,各地级以上市至少有1个县(市、区)初步建成目标明确、权责清晰、分工协作、服务优质、有效运行的县域医共体,医共体所在县域内就诊率达到90%左右,住院率达到85%左右,基层就诊率达到65%左右。
广东县域医共体将实现实行行政、人员、财务、质量、药械、信息系统“六统一”。其中在药械管理方面,县域医共体将设立唯一药械采购账户,用药目录、采购配送、药款支付统一,支持以县域医共体为单位在药品采购平台自行议价。这意味着县域医共体的牵头单位“大权在握”,药品采购、用药、配送及药款结算都将集中在牵头单位做出决策。
广东集采扩围明年1月执行,除广深外,全省统一医保支付
10月12日,广东省医保局发布《关于全省推进落实国家组织药品集中采购和使用试点扩围工作实施方案(征求意见稿)》,计划明年1月起正式执行。除广州、深圳执行原4+7集采外,其他区域组成省级采购联盟,全省统一医保支付标准。
其中,非中选价格高于中选价2倍以上的品种,医保支付标准按首年降30%、第二年降30%,第三年与中选价趋同的方式制定。此外,对于非中选药品,将采集省、广州、深圳GPO平台价格,取最低值作为其采购价格。
集采扩围各省不断落地,湖南、吉林12月执行;海南明年1月正式实施!
10月16日,吉林医保局起草了《吉林省关于做好国家组织药品集中采购和使用试点扩大区域范围的实施意见(代拟稿)》,决定今年12月正式实施集采扩围结果。征求意见截止日期为2019年10月31日。
另外,据网传,湖南省医疗保障局办公室日前发布《湖南省全面落实国家药品集中带量采购“4+7”实施方案》,全省将于 2019 年 12 月 31 日前启动试点工作。
10月18日,海南省医保局发布《海南省全面落实国家组织药品集中采购和使用试点扩围工作实施方案(征求意见稿)》,明确2020年1月1日起,正式执行国家药品集中采购扩围结果和配套政策,同步执行医保支付标准,此次意见稿公示时间:2019年10月18日至2019年10月27日。
江苏高值耗材:医保支付配套措施出台,采购量完成后仍优先选用中选品种
近日,江苏省医保局发布了该省高值医用耗材联盟采购医保支付配套措施。明确,医保经办机构应在医保基金总额预算的基础上,按照不低于采购总金额的30%及时预付给医疗机构。医疗机构要按合同约定及时与企业结算货款。鼓励有条件的地区由医保基金与企业直接结算货款。
医疗机构应按购销合同完成相关高值医用耗材的采购量,采购量完成后仍应优先使用中选品种;要规范中选品种使用,若采购周期内总使用量下降,原则上采购中选品种不得低于总采购量的70%。省医保局将每月通报联盟采购品种采购情况。国家、省药品(医用耗材)集中采购以及各地集中采购资金预付参照执行。
4+7扩围落地在即,余量市场不会对中选品种倾斜
近日,据业界人士透露,10月12日,上海联采办召开了企业沟通会议。据悉,国家医保局要求做到“四个确保”,企业要保质量保供应,政府保检测保回款,药监系统会加强监测及检查。尤其是刚过评还未投入生产的产品需要重点关注,质量是红线。
同时,也明确了国家契约规定的内容比完成只多不少;另外,针对非供应中选省份,标书中明确规定的内容外,不会再做任何倾向性政策指引。
目前各地平台与国家平台对接已基本就绪,联采办会同时检测中选的60个品规和9000个替代品及相应品规。
对于3家企业不同中选价,各省制定各省的政策,各省余量市场,也由各省制定,主要看由各医院自主选择。预计原研药和价格最低的产品在余量市场上较有竞争优势,同时,余量市场不会对中选产品有倾斜,建议各企业顺应趋势,逐步降价。
公立医院用药:抗肿瘤和免疫调节剂使用金额占比超过抗感染药物 中国药学会日前发布《中国药学会2018年度医院用药监测报告》,从各类药品的品种数、使用金额、使用频度三个维度入手,对2018年度医院药品使用及近五年来的趋势变化情况进行了深度剖析。
值得注意的是,抗肿瘤和免疫调节剂的使用金额占比在2018年首次超过全身用抗感染药物,跃居金额占比的第一位,且其在五年内使用金额占比的增幅亦处于首位。(中国药学会)
媒体报道:赛诺菲解散波立维销售及医学团队?
据《第一财经》报道,赛诺菲中国已在解散波立维的医学团队以及销售团队。不过,第一财经记者试图进一步向赛诺菲中国公关部了解情况,截至发稿时,尚未获得回应。
赛诺菲在集采扩围中两个品种拟中选,其中波立维75mg以2.544元/片的报价,甚至低于4+7中选厂家信立泰,最终获得中选资格,与石药集团、乐普药业三家共同瓜分氯吡格雷公立医院70%的存量市场,采购周期至少2年。
据相关数据显示,波立维占有近60%左右的市场份额,在4+7集采试点中落选后,信立泰占据了11个城市的带量采购市场份额,集采扩围赛诺菲如果再失去中选资格,那么未来两年内剩余的市场很有可能被其他国内企业瓜分蚕食。因此,集采扩围不惜报出比信立泰更低的价格胜出,与4+7集采相比,降幅近20%。
而与此同时,另一个问题也接踵而来,降价后的波立维利润空间遭受严重挤压,能否支撑相关人员的运营?或者,还是否有必要继续保留销售团队?毕竟带量采购项目是保障完成中选品种的采购量的。
可以预见的是,不管是跨国药企还是国内药企,也不管是在集采扩围中是否中选,未来的营销都面临重大转型。解散团队或许是从成本费用效益上考虑,但企业面临的下一步如何调整则是每家企业都需要作出决策的时候了。
未过评,177个药品被暂停挂网,各省加速“关闸”!
10月14日,辽宁省药品和医用耗材连发两通知,对通过一致性评价药品挂网采购工作做进一步规范,多个药品被暂停采购。
2016年3月5日,国务院办公厅印发的《关于开展仿制药质量和疗效一致性评价的意见(国办发〔2016〕8号)》,明确要求,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
10月16日,江苏省公共资源交易中心发布《关于暂停采购未通过仿制药质量和疗效一致性评价药品的通知》,40个药被暂停采购。
据悉,已有北京、上海、广东等19个省份开始执行“已有三家过一致性评价品种的未过厂家暂停交易资格”规定。未来,无法通过一致性评价的产品将难以获得市场准入,优质仿制药市场份额将持续增加。不过,这些品种一旦过评,仍可通过备案采购、挂网、甚至带量采购的方式进入市场。
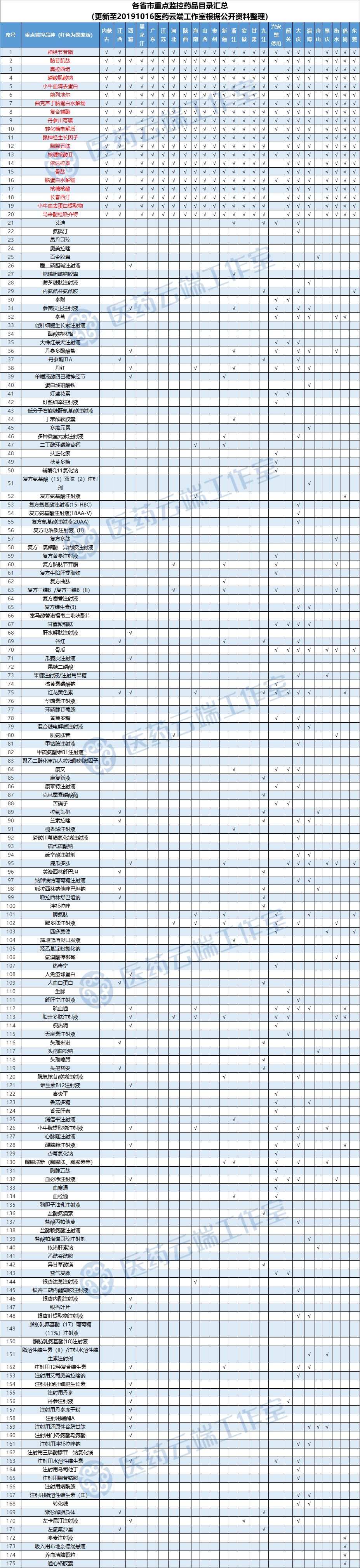
趋势:中成药“限方”对基层松动,重点监控药品达175个
西医被限制中成药处方权,从国家卫健委的一纸通知到省级卫健委,再到医疗机构,已逐渐进入落地层面。目前,河北、青岛、山东、海南、内蒙古、新疆等卫健部门、一些医疗机构相继发文,对中成药的处方权进行约束和管控。
不过,据网传,2019年8月30日,在全国推进医疗机构合理用药管理工作电视电话会议上,国家卫健委医政医管局张宗久局长对于西医师处方中成药的政策做了最新解读,被业界理解为这是为中成药限方消除“紧箍咒”。
这个解读虽然没有官宣,但确是一个重要的转折点,确确实实在省级层面打开了一扇窗户。此后,多个省解除二级医院中成药“限方”障碍,不做硬性要求。而从近期发布的各省文件来看,此趋势越加明显,看来基层市场将成为中药的未来战场。
山西重点监控药品增加两类,并规定重点监控品种使用、外购均需院长签字
近日,山西省卫健委发布重点监控合理用药药品目录,在国家卫健委公布的20个品的基础上增加质子泵抑制剂(包括奥美拉唑、泮托拉唑、兰索拉唑、雷贝拉唑、艾司奥美拉唑等)、银杏叶提取物两类药品,共计22种(类)药品。
而在一同公布的《山西省第一批重点监控合理用药药品(化药及生物制品)临床使用管理细则》中,对22种(类)药品列出了详细的适应症、证据说明、推荐意见、管理要求等,其中有16种(类)药品推荐意见栏里面直接注上不推荐使用,同时在管理要求中还明确“如需使用,需会诊、由主管院长签字确认”,且“不得外购,如需外购,需由主管院长签字确认”。
附各省市重点监控目录情况汇编:
目前,已有15省、9市、5家医院公开重点监控药品目录,涉及175个品种。医药云端工作室也进行了品种频率统计,详见后表。从已发布的目录来看,各地市、医院自行增补的较多。
阿仑膦酸钠片等13个药品批文被注销,涉7家企业
10月15日,国家药监局发布《关于注销阿仑膦酸钠片等13个药品批准文号的公告(2019年第79号)》,根据相关规定,阿仑膦酸钠片等13个药品批准文号被注销,涉及黄河药业等7家药企。
公告显示,这13个药品包括阿仑膦酸钠片、地塞米松磷酸钠注射液、盐酸异丙肾上腺素气雾剂、丙酸倍氯米松气雾剂、氧氟沙星滴耳液、富马酸依美斯汀滴眼液、洛度沙胺滴眼液、曲伏前列素滴眼液、梅毒甲苯胺红不加热血清试验诊断试剂等。
本周一致性评价工作进展:豪森第9个首家过评药品诞生,“福沙匹坦双葡甲胺”首仿上市
10月16日,翰森制药发布公告称,其附属公司江苏豪森药业开发的注射用福沙匹坦双葡甲胺(商品名坦能)获国家药监局批准上市。该药品按照化药新3类申报,获批后视同通过一致性评价。坦能也成为国内首个及目前唯一获批上市的福沙匹坦双葡甲胺。
上海现代制药全资子公司国药集团汕头金石制药有限公司获得国家药监局核准签发的头孢呋辛酯片(0.5g)《药品补充申请批件》, 批准该药品通过一致性评价。
据医药云端工作室不完全统计,截止目前,共有403个品规通过一致性评价。其中35个品种已集齐三家以上过评(统计持续更新中):苯磺酸氨氯地平片已有12个厂家通过;蒙脱石散已有10个厂家通过;富马酸替诺福韦二吡呋酯片、盐酸二甲双胍缓释片已有9个厂家通过;盐酸二甲双胍片、头孢呋辛酯片已有7个厂家通过;瑞舒伐他汀钙片(10mg)、盐酸左西替利嗪片已有6个厂家通过;瑞舒伐他汀钙片(5mg)已有5个厂家通过;恩替卡韦胶囊、恩替卡韦分散片、阿莫西林胶囊、异烟肼片、阿托伐他汀钙片(10mg),格列美脲片(1mg/2mg)、盐酸克林霉素胶囊(0.15g)奥美沙坦酯片(20mg)、利培酮片、聚乙二醇4000散、替格瑞洛片12个品规已有4个厂家过评。
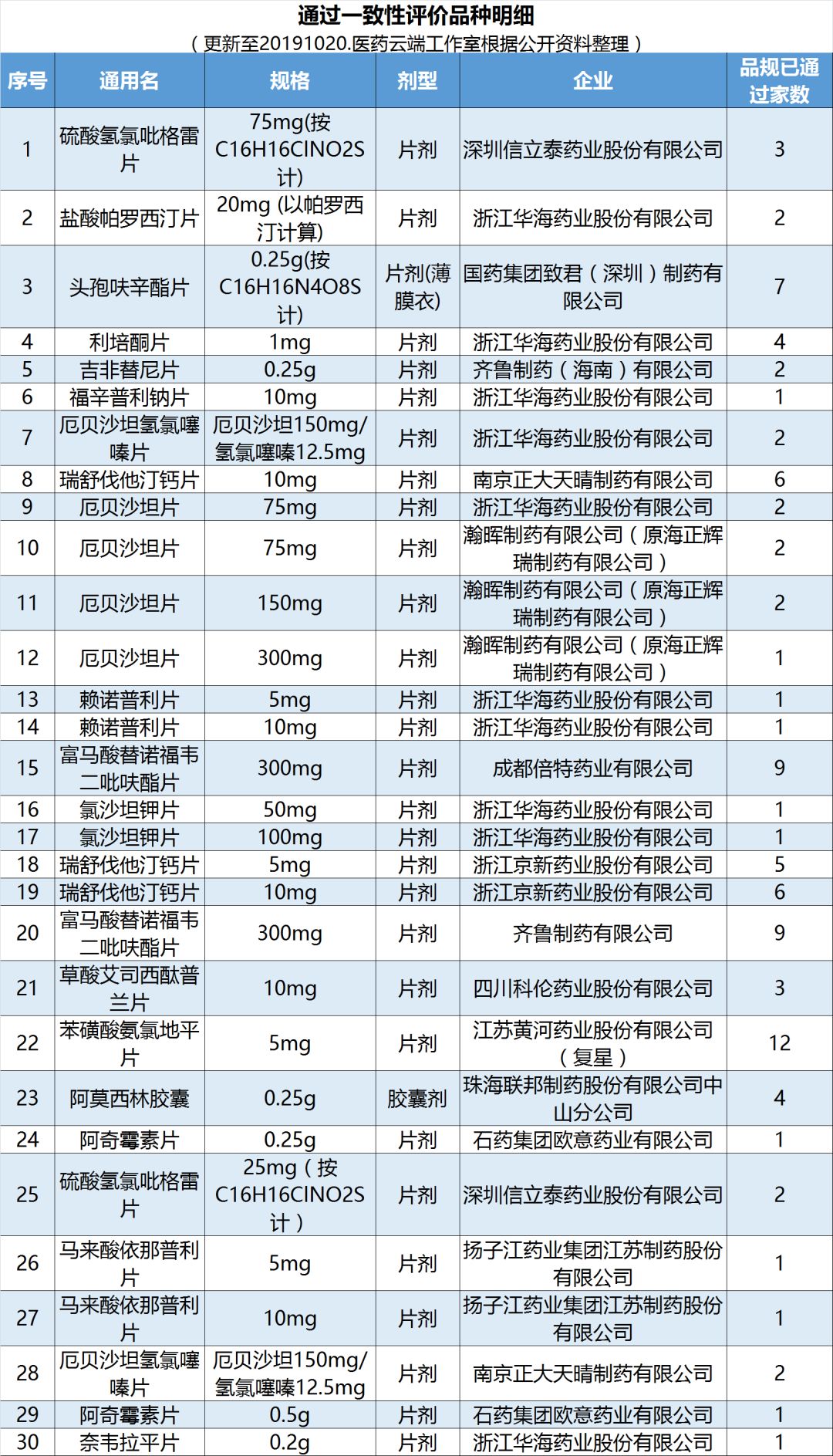
限于篇幅,本文为部分过评品种截图,完整表格索取,欢迎加入药事达会员