
新浪科技
科技观潮,与浪前行
关注

来源 | 敲黑板(ID:qiaoheiban8)
文 | 贡晓丽
内容经授权发布
老年痴呆症可能有救了!
美国生物技术公司百健(Biogen)和日本制药公司卫材(Eisai)今日联合宣布,在与美国食品药品监督管理局(FDA)和外部专家讨论之后,他们计划于2020年初向FDA递交阿尔茨海默病在研药物aducanumab的生物制剂许可上市申请(BLA)。
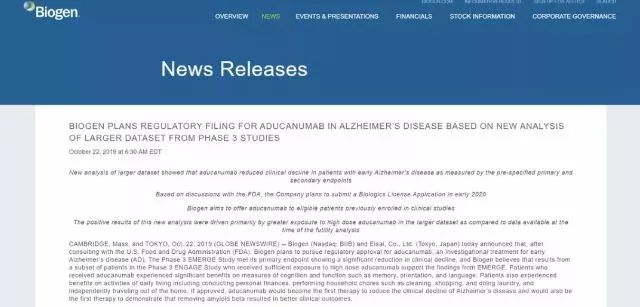
▲图片来源:Biogen 官网
这是一次惊天大逆转,今年3月21日,百健和卫材曾因无效性分析结果不理想,宣布停止aducanumab的两项3期临床试验,而在此之前,礼来、辉瑞、强生、罗氏、葛兰素史克、默沙东等全球顶尖药企,纷纷在阿尔茨海默病新药研发领域折戟沉沙。人类战胜阿尔茨海默病的那天看起来遥遥无期。
如今,aducanumab“起死回生”的消息,顿时震惊了整个世界,受此重大利好影响,百健股价开盘一度大涨近40%。
全球每3秒多一位
AD患者
阿尔茨海默病(Alzheimer's Disease, AD),俗称老年痴呆症,是一种神经系统退行性疾病,它导致大脑中神经细胞逐步受损和死亡,造成患者的认知能力和其它大脑功能随着时间推移持续下降。
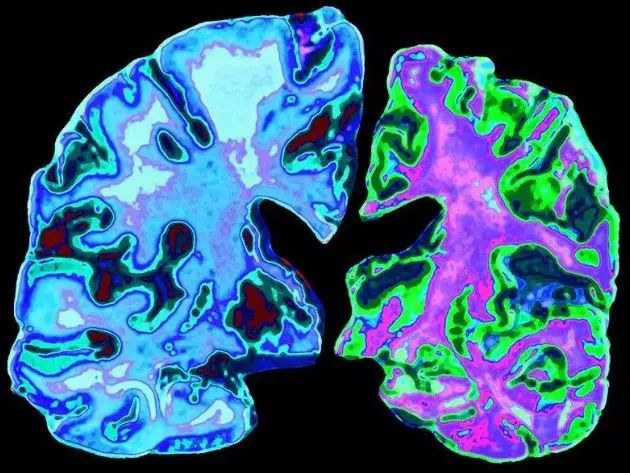
▲与 70 岁的正常大脑(左)相比,70 岁阿尔茨海默病患者的大脑切片
图片来源:Jessica Wilson/Science Photo Library
1906年,德国精神病学家和病理学家爱罗斯·阿尔茨海默首次发现并以他的名字命名这种疾病,如今百余年过去,人类仍旧未能揭开这种疾病的神秘面纱。
这种疾病多发于65岁以上的老年人,随着年龄增长大幅增加患病风险,85岁以上的人群中患病风险约为50%。而且通常,患者确诊后的平均存活时间仅为3至9年。
国际阿尔茨海默病协会(ADI)发布的《世界阿尔茨海默病2018年报告》显示,每3秒钟,全球就有一位痴呆症患者产生,全球目前至少有5000万的痴呆患者,其中约60-70%为AD患者。
在中国,目前约有1000万AD患者,而在西方发达国家,阿尔茨海默病也是耗费社会财政补助的主要疾病之一。以美国为例,大约有550万AD患者,每年全社会花费高达2590亿美金。
目前,阿尔茨海默病的治疗方式主要是辅助性治疗,还没有彻底治愈该疾病的药物。
所有制药巨头
都饮恨而归
无药可治,是因为人类至今尚未弄清阿尔茨海默病的致病机理。
通过多年研究,目前人类已知AD患者的典型特征是脑萎缩。
在显微镜下,病患大脑中的β淀粉样斑块和神经纤维缠结清晰可见,其中神经纤维结是由Tau蛋白质过度磷酸化并且堆积在细胞内聚集而成。

▲AD患者脑中的神经原纤维缠结
图片来源:健康新闻
这种典型特征,让阿尔茨海默症的致病机理有了三种主要假说:
一是遗传因素致病。通过研究家族性的AD患者发现,基因突变造成Aβ42 积累,导致蛋白沉积产生。
二是β淀粉样蛋白假说。这个假说提出Aβ蛋白积累形成Aβ沉淀的核心,引发神经毒性作用。
三是Tau蛋白假说。这个假说提出Tau蛋白结构异化导致大量Tau蛋白在脑细胞里积累,破坏了细胞结构,终止了神经传输终止。
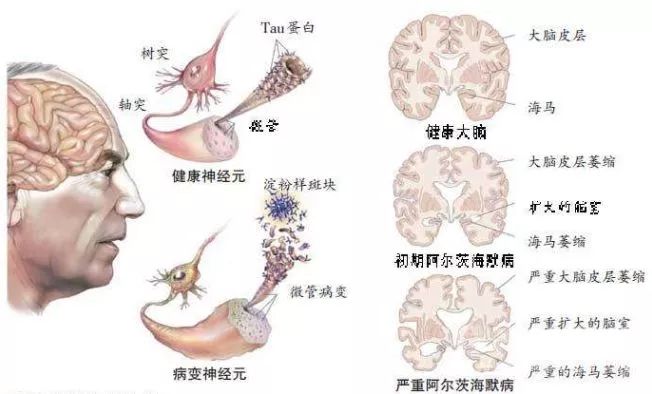
▲图片来源:国际检验医学
这些假说,让众多新药临床试验围绕靶向β淀粉样蛋白和Tau蛋白展开,但过去20年来,阿尔茨海默氏病的新药研发全军覆没,下面这一长串“阵亡”名单上,几乎包含了每一家制药巨头:
2012年,强生/辉瑞的单抗药物bapineuzumab在III期临床惨遭失败;
2014年,瑞士制药巨头罗氏的单抗药物gantenerumab也以失败告终,该药物旨在清除AD患者大脑中的β淀粉样蛋白斑块;
2016年,制药巨头礼来的阿兹海默病新药solanezumab在III期临床试验中功亏一篑,一度动摇了业界对β淀粉样蛋白假说真实性的信心;
2017年,默沙东宣布停止开发BACE抑制剂(以减低血浆中β淀粉样蛋白水平)药物verubecestat;
2018年,强生宣布终止了BACE抑制剂atabecestat的II/III期研究,原因是观察到了严重的肝酶升高,药物本身的获益/风险不理想;
2018年,礼来/阿斯利康宣布终止lanabecestat(口服BACE抑制剂)治疗阿尔茨海默病的全球III期项目。
至此,几乎所有阿尔茨海默病新药研发均以惨败告终,数十亿美元、数十年人力的投入,纷纷打了水漂。
来自健康老年人的
Aducanumab
在讲述百健和卫材的历史性突破之前,我们有必要先了解下什么是Aducanumab。
Aducanumab是一种靶向β淀粉样蛋白的单克隆抗体,可以结合β淀粉样蛋白,防止其聚集成斑块,由Neurimmune公司从健康老年人的B细胞库中发现。
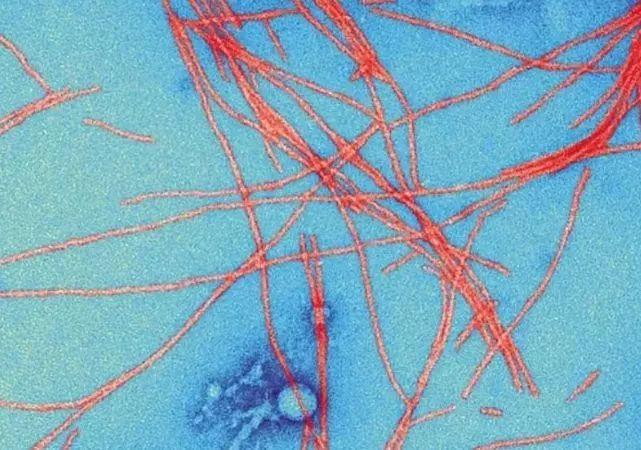
▲β 淀粉样蛋白异常折叠形成的斑块,被认为与阿尔茨海默病相关
图片来源:Science Source / SPL
这些老年人虽然年事已高,但是并没有表现出认知能力的下降,或者认知能力下降的速度要比普通人缓慢得多。科学家们猜测他们身体里可能有什么因素能够对抗Aβ的沉积,Aducanumab正是Neurimmune公司通过研究发现的答案。
2007年,百健从Neurimmune获得了该药物的开发和营销权。
2017年8月,在已经完成的临床1b期试验中,百健发现aducanumab能够显著降低轻度AD患者大脑中β淀粉样蛋白的程度,这坚定了他们持续投入开发新药的决心。
2017年10月,百健宣布与Neurimmune修订了在研药物aducanumab的研发和营销协议。根据新的协议,百健将一次性付给Neurimmune1.5亿美元,如果未来该药物获得FDA批准成功上市,百健付给Neurimmune公司的专利费率将降低15%。
与此同时,日本卫材药业也选择加入到aducanumab的后期研发过程中,以换取该药物上市后的利益分成。
抗击阿尔茨海默病发
历史里程碑
2015年8月和9月,为评估aducanumab的疗效和安全性,百健先后启动了两项3期临床试验,分别名为ENGAGE(1647名患者)和EMERGE(1638名患者)。
这些临床试验招募的是因为AD出现轻微认知障碍的早期患者,脑补扫描显示,这些患者的大脑中β淀粉样蛋白水平升高,他们分别接受了三种不同剂量aducanumab的治疗(3 mg/kg, 6 mg/kg, 10 mg/kg)。
然而,2019年3月,独立数据监督委员会完成了对试验中期数据的无效性分析。这种提前分析可以判断在研新药有没有可能达到预期效果,从而防止医药公司投入大量资源和时间去进行最终无效的临床试验。
无效性分析的结果表明,aducanumab达到预期效果的可能性很小。因此,百健和卫材在3月21日宣布终止3期临床试验。受此消息影响,百健股价当天收跌29.23%,创十四年来最大单日跌幅,市值蒸发近180亿美元。
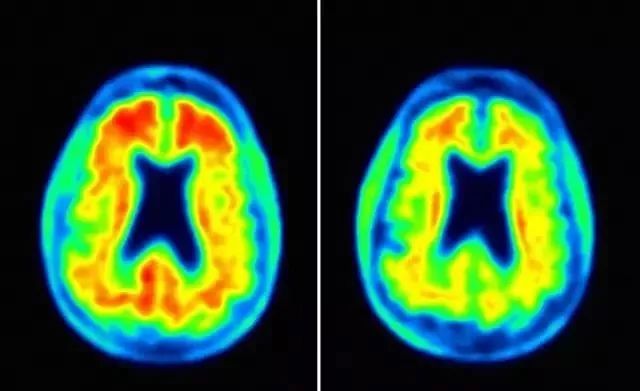
▲Aducanumab治疗(右)可减少淀粉样蛋白斑块
图片来源:Fortune
然而,在宣布终止临床试验后,百健对包含全部3285名患者的数据集进行了分析,发现在EMERGE的临床试验中,接受高剂量(10 mg/kg)aducanumab治疗的AD患者,认知能力评分与对照组相比降低了23%,获得了显著统计学意义上的改善。而在ENGAGE的临床试验中,持续接受高剂量aducanumab治疗的部分患者的认知能力也得到了提高。这些患者在认知和功能测试(如记忆、定向和语言)方面有显著改善,也可以更好地处理个人财务、做家务,甚至独自出门旅行。
在向FDA咨询后,百健认为大数据集的新分析结果与无效性分析结果之间的差异,主要是因为在最新分析的更大数据集中,多重因素导致了更高的aducanumab接触。
根据与FDA的讨论结果,百健和卫材计划在2020年初提交生物制品许可证申请(BLA),提交的BLA报告将包括 1/1b 期研究的数据以及3期临床试验的完整数据集。
如果获得上市批准,aducanumab将成为第一个减少阿尔茨海默病临床衰退的疗法,并成为抗击阿尔茨海默病历史上的里程碑事件,也会给医生、患者及家属带去新希望,极大激励后续阿尔茨海默病的新药研发。
参考资料
《阿尔茨海默病新药起死回生!它为啥能迎来“惊天逆转”?》 来源:药明康德
《百健与Neurimmune签订药物研发和营销协议》 来源:药明康德
《大反转!曾宣告失败的阿尔茨海默病新药起死回生,明年初申请上市》 来源:DeepTech深科技
《走进几乎全军覆没的阿尔茨海默症新药领域 》 来源:乐美好医LINKMedicine
(本文仅代表作者观点,不代表新浪科技立场)
